化疗可诱导肿瘤抗原释放,但肿瘤免疫微环境抑制、佐剂递送效率低及系统毒性等问题严重限制了协同免疫治疗的疗效。如何精准调控“抗原释放–免疫激活”的时间窗口,提升肿瘤特异性免疫反应,是肿瘤免疫治疗领域亟需解决的重要课题。近日,沈阳药科大学无涯创新学院王永军教授团队开发出一种靶向淋巴结的STING激动剂纳米佐剂(Mn/MSA-2@Lipo),并提出“化疗先行–纳米佐剂延迟注射”的时序递送策略,在多种小鼠肿瘤模型中实现了完全缓解、长期免疫记忆及显著抗转移效果。相关成果以研究论文形式发表于Science Advances(Q1,IF=12.5)。
MSA-2 是一种高亲和力的STING激动剂,但其口服利用度极低,系统给药易引起毒性,难以高效作用于免疫活性位点(如淋巴结)。为此,团队构建了基于脂质体的Mn/MSA-2@Lipo纳米佐剂,利用锰离子放大STING信号通路,并通过远程载药策略实现了极高的药物封装率与淋巴结靶向递送。研究发现,该纳米系统可显著提高树突状细胞的吞噬能力、成熟水平与抗原交叉呈递能力,并激活强效CD8⁺ T细胞免疫反应。
值得注意的是,研究团队系统评估了不同给药时间对治疗效果的影响,证实“在化疗后48小时注射Mn/MSA-2@Lipo”可最大程度激活抗肿瘤免疫。这一发现基于DC成熟后吞噬能力下降的生物学规律,通过时序精控,保障DC在抗原摄取高峰前完成抗原摄入后再被激活。最终,该组合策略在B16F10黑色素瘤、4T1乳腺癌、CT26结肠癌等模型中均实现了完全缓解,并在肺转移模型中显著抑制肺结节形成,同时诱导持久的CD8⁺记忆T细胞应答。
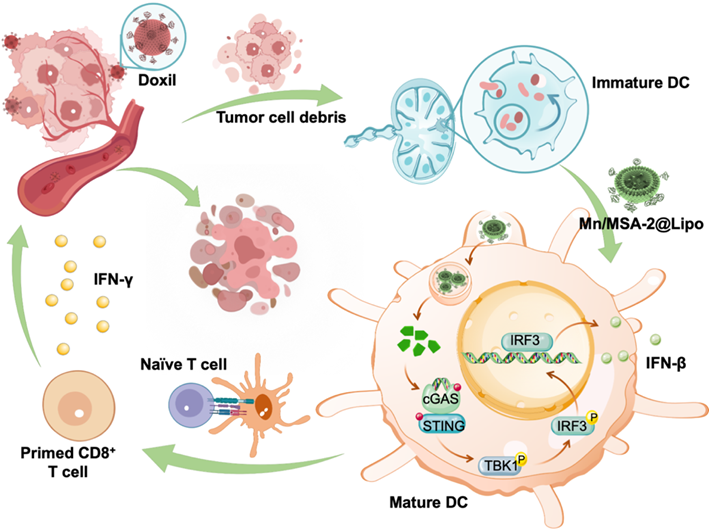
图1 STING纳米佐剂协同化疗的时序递送策略机制图
该工作具有以下研究亮点:
1. 精准时序控制:化疗诱导肿瘤抗原释放,48小时后递送纳米佐剂可避免DC过早成熟,提高抗原摄取与呈递效率;
2. 强效免疫激活:锰离子增强STING通路活性,提高IFN-β、TNF-α、IL-6等炎性因子分泌,促进DC成熟与T细胞活化;
3. 多癌种验证:策略在黑色素瘤、乳腺癌、结肠癌等多种模型中均表现出完全缓解及免疫记忆;
4. 良好生物安全性:纳米佐剂粒径控制在~80 nm,PEG修饰保证良好稳定性与组织相容性,未见明显毒副反应。
本研究不仅验证了STING激动剂的时序递送价值,更提出了“抗原释放–免疫激活不同步”需人为校准的概念,为未来STING类免疫佐剂的临床转化和多模式肿瘤治疗提供了新的范式。其可广泛拓展应用于多种需配合抗原释放的免疫治疗方案中,为精准时控免疫治疗奠定基础。
2021级博士研究生杨子蒙为论文第一作者,王永军教授、刘洪卓教授、何仲贵教授为本文共同通讯作者,沈阳药科大学为第一通讯单位。该研究得到了国家自然科学基金(No. 82273878和No.82473872)和沈阳市自然科学基金(No. 23-503-6-11)的资助。
原文链接:https://www.science.org/doi/10.1126/sciadv.adw0797