重组腺相关病毒(rAAV)疗法是现阶段基因疗法的关键研究领域之一。然而,针对rAAV衣壳蛋白或编码基因蛋白产物的抗药物抗体(ADA)显著阻碍了rAAV的临床应用进展:(1)体内预存抗AAV ADA的血清阳性患者无法通过受试者筛选,极大限制了rAAV基因疗法的人群适用性;(2)rAAV基因组转导细胞后随着细胞分裂被逐渐稀释,在治疗周期内需要重复给药以确保转基因的持续表达,但抗AAV ADA会消除rAAV重复给药的治疗效果;(3)为克服体内预存ADA对单次给药的基因转导效率限制,患者通常需要接受高剂量rAAV治疗,但可能引发严重副作用。因此,开发有效克服抗AAV ADA的策略,是拓展rAAV治疗潜力的关键。
为此,沈阳药科大学无涯创新学院刘洪卓教授团队设计了系列以雷帕霉素(Rapa)为基础的前药自组装纳米递送策略,诱导针对rAAV衣壳的抗原特异性耐受反应,为rAAV基因疗法再给药难题提供了全新的解决思路与实验依据。近期,团队分别开展了如下工作:
研究工作1
Rapa在通过诱导tolDC并扩增Treg来诱导生物制剂免疫耐受展现了一定的治疗潜力。然而,Rapa通过选择性抑制mTORc1促进Treg分化,但会通过反馈环路激活mTORc2,进而促进滤泡辅助T细胞(Tfh)扩增,增强B细胞功能,抵消耐受作用;在复杂的炎症环境中诱导的Treg无法持续保持免疫抑制能力,甚至表现出促炎特征。衣康酸(ITA)能够弥补Rapa的不足,例如ITA通过抑制糖酵解选择性阻断Tfh增殖而不影响Treg,干预Tfh-B细胞反应能够独立于DC-Treg诱导耐受;ITA抑制CD8⁺ T细胞对转导细胞的杀伤。基于此,本研究提出将Rapa和ITA的组合作为纳米佐剂,通过靶向肝脏协同调控DC-Treg和Tfh-B细胞轴,诱导针对rAAV衣壳的抗原特异性耐受反应,以克服rAAV再给药的免疫屏障。分别建立了3种编码不同基因的rAAV重复给药模型,以第二剂rAAV载体包装基因的表达(分别为荧光素酶、绿色荧光蛋白以及分泌型碱性磷酸酶)为指标,评估RICP对于rAAV重复给药的益处。经RICP治疗的小鼠首次接受rAAV给药后,其基因表达量与未治疗组无差异;当接受第二剂rAAV给药后,可实现治疗基因的表达提高;相比之下,抗AAV ADA会导致未治疗组小鼠第二剂AAV编码基因的转导失败。这是因为未进行RICP治疗组小鼠体内出现了阻断rAAV转导的中和抗体。
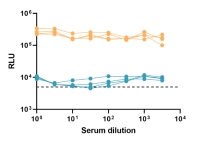
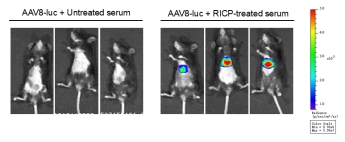
Fig. (left): RICP-treated serum (orange) and untreated mice serum (blue), after incubation with AAV-Luc and infection of 293T cells, showed Luc activity. Gray bar represented that Luc expression of AAV8-Luc-untreated 293T cells. n=4. (right): In vivo bioluminescence imaging of mice injected with AAV-luc pre-incubated with serum from RICP treated or untreated mice.
研究成果不仅可解决rAAV临床应用的共性技术难题,其建立的联合耐受诱导策略还可拓展至其他生物制剂的免疫原性控制领域。
相关工作发表在《Materials horizons》(IF=12.2),题为“Nanotherapeutics-mediated tolerogenic Induction for Enabling Adeno-Associated Virus Vector Gene Therapy Re-administration by Overcoming Anti-drug antibodies”。我校2022级博士研究生刘宇博为论文第一作者,我校无涯创新学院刘洪卓教授,何仲贵教授以及王永军教授为共同通讯作者。原文链接:https://doi.org/10.1039/D5MH00203F
研究工作2
前述工作证明了以Rapa为基础的前药共组装纳米颗粒对于抗AAV ADA具有显著的抑制作用,但并未考察更高剂量rAAV的应用场景。临床发现rAAV用药剂量超过1.0 × 10^13 vg/kg时,可能会过度激活补体系统,引发血栓微血管症等严重的不良反应。目前临床上主要通过使用免疫抑制剂、进行血浆置换以及耗竭免疫细胞等策略来解决宿主对rAAV的免疫反应。这些策略已被证明能够缓解中低剂量rAAV重复给药引起的免疫反应,但无法有效处理高剂量rAAV重复给药所导致的免疫反应及补体系统过度激活的问题。为此,本研究将雷帕霉素脂质前药与地塞米松棕榈酸酯进行共组装,以制备能够同时诱导调节性T细胞生成并抑制滤泡辅助性T细胞生成的共组装纳米粒。通过调节T细胞表型,这些共组装纳米颗粒可减少生发中心B细胞生成,并抑制抗rAAV-IgG及抗rAAV-IgM产生,以及补体系统过度激活,从而允许高剂量rAAV重复给药并增强所递送基因表达。
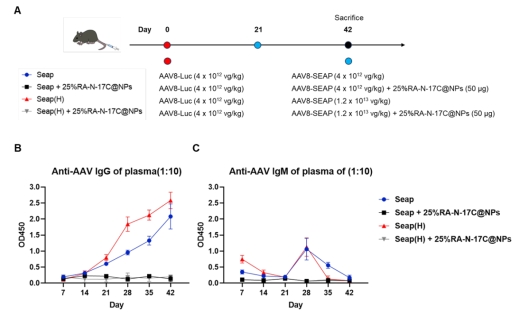
Fig. Effect of 25 % RA-N-17C@NPs on AAV re-administration. (A) Timeline of 25 % RA-N-17C@NPs allowing high dose AAV re-administration studies. (B) Anti-AAV8 IgG dynamics in mice after AAV re-administration. (C) Anti-AAV8 IgM dynamics in mice after AAV re-administration.
相关研究工作发表在《Chemical Engineering Journal》(IF = 13.4),题为“Nanovaccine enables complement system inhibition and high-dose AAV re-administration”。我校2024级博士研究生廖仲豪为论文第一作者,我校刘洪卓教授和王永军教授为共同通讯作者。原文链接:https://doi.org/10.1016/j.cej.2025.160810
研究工作3
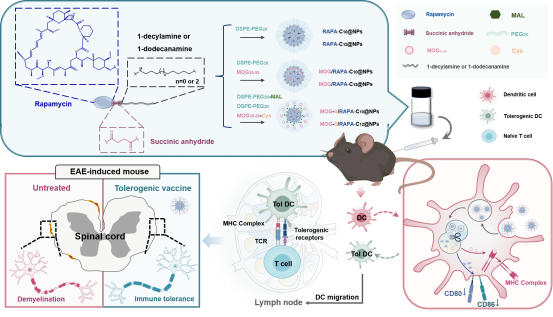
为了拓展Rapa前药自组装纳米颗粒更多的临床应用场景,本研究通过点击化学技术将抗原MOG35-55修饰到纳米颗粒的表面,从而实现免疫调节剂和抗原的协同递送。
对于治疗多发性硬化症等自身免疫性疾病而言,受载体材料对包载组分理化性质的限制而存在载药率低和活性成分递送不同步的问题。因此,优化抗原和免疫调节剂的纳米联合递送系统以有效诱导抗原特异性免疫耐受仍是一项挑战。为解决上述问题,本研究提出将抗原与雷帕霉素协同递送至抗原提呈细胞(APCs),从而诱导APCs向耐受表型偏转,进而产生抗原特异性免疫耐受。研究结果表明,这些带有表面修饰抗原的前药纳米粒在体外被APCs高效摄取,并在多发性硬化症的临床前模型—实验性自身免疫脑脊髓炎(EAE)小鼠模型中诱导出更明显的免疫耐受效应。这种递送平台不仅为多发性硬化症,也为其他自身免疫性疾病提供了一种更精确、更有效的治疗策略,可在最大限度地减少脱靶效应的同时取得更好的治疗效果。
相关工作发表于《Journal of Colloid and Interface Science》(IF=9.4),题为“Self-assembled Nanoparticles of Rapamycin Prodrugs for the Treatment of Multiple Sclerosis”。我校2022级硕士研究生张蕊为论文第一作者,我校无涯创新学院刘洪卓教授和药学院教师杨杨为共同通讯作者,原文链接:https://doi.org/10.1016/j.jcis.2024.12.195